Базель, 19 февраля 2020 г. — Компания «Рош» сообщила, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) приняла заявку на регистрацию по приоритетному протоколу дополнительного показания к применению препарата атезолизумаб (Тецентрик®) в качестве первой (начальной) линии монотерапии для пациентов с распространенным неплоскоклеточным и плоскоклеточным немелкоклеточным раком легкого (НМРЛ) без мутаций EGFR или ALK с высоким уровнем экспрессии PD-L1 (ОК3/ИК3 дикого типа (ДТ), что означает отсутствие опухолевых мутаций EGFR/ALK), что определялось по результатам тестирования на биомаркер PD-L1. Ожидается, что решение по регистрации будет принято к 19 июня 2020 года.
«В исследовании IMpower110 атезолизумаб в режиме монотерапии продемонстрировал значительное улучшение общей выживаемости по сравнению с химиотерапией у пациентов с впервые установленным диагнозом распространенного немелкоклеточного рака легкого определенных типов, — комментирует Леви Гарруэй, главный медицинский директор и глава глобального подразделения по разработке лекарственных препаратов компании “Рош”. — Мы тесно сотрудничаем с FDA, чтобы этот вариант лечения стал как можно скорее доступен для пациентов».
В основу заявки на регистрацию положены результаты исследования III фазы IMpower110, в котором монотерапия атезолизумабом улучшила общую выживаемость (ОВ) на 7,1 месяца по сравнению с химиотерапией (медиана ОВ=20,2 и 13,1 месяца, соответственно; отношение рисков [HR]=0,595, 95% доверительный интервал: 0,398-0,890; p=0,0106) у пациентов с высоким уровнем экспрессии PD-L1 (ОК3/ИК3-ДТ). Безопасность атезолизумаба соответствовала известному профилю безопасности препарата, новых сигналов безопасности выявлено не было. Связанные с проводимым лечением нежелательные явления (НЯ) 3–4 степени тяжести наблюдались у 12,9% пациентов, получавших атезолизумаб, и у 44,1% пациентов, получавших химиотерапию [1].
Компания «Рош» реализует обширную программу клинических исследований препарата атезолизумаб. Она включает продолжающиеся и планируемые исследования III фазы при раке легкого, мочеполовой системы, кожи, молочной железы, желудочно-кишечного тракта, гинекологических онкологических заболеваниях, раке головы и шеи. В этих исследованиях атезолизумаб оценивается как самостоятельно, так и в комбинации с другими препаратами.
Об исследовании IMpower110
IMpower110 — рандомизированное открытое клиническое исследование III фазы по оценке
эффективности и безопасности монотерапии препаратом атезолизумаб по сравнению с цисплатином или карбоплатином и пеметрекседом или гемцитабином (химиотерапия) при лечении ранее не получавших химиотерапию пациентов с метастатическим неплоскоклеточным и плоскоклеточным НМРЛ без мутаций ALK или EGFR (дикий тип). Общее количество участников составило 572 (555 — с диким типом); все участники были рандомизированы в отношении 1:1 для получения:
- монотерапии препаратом атезолизумаб, до утраты клинической пользы (по оценке исследователя), неприемлемой токсичности или смерти пациента, или
- цисплатина или карбоплатина (на усмотрение исследователя) в комбинации с пеметрекседом (при неплоскоклеточной форме) или гемцитабином (при плоскоклеточной форме), с последующей поддерживающей терапией пеметрекседом (при неплоскоклеточной форме) или наилучшим методом поддерживающей терапии (при плоскоклеточной форме) до прогрессирования заболевания, неприемлемой токсичности или смерти пациента.
Первичной конечной точкой по эффективности является ОВ в подгруппе PD-L1 (ОК3/ИК3-ДТ; ОК2,3/ИК2,3-ДТ и ОК1,2,3/ИК1,2,3-ДТ), определявшейся по результатам теста SP142. Ключевые вторичные конечные точки включают оцениваемую исследователем выживаемость без прогрессирования (ВБП), частоту объективного ответа (ЧОО) и длительность ответа (ДО).
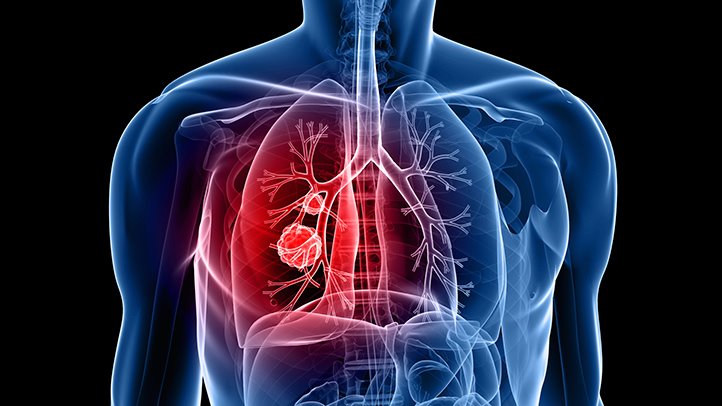
О немелкоклеточном раке легкого
Рак легкого является ключевой причиной онкологической смертности в мире [1]. Ежегодно заболевание уносит жизни 1,76 млн человек во всем мире; это более 4800 смертей каждый день. Разделяют два основных типа заболевания — немелкоклеточный рак легкого (НМРЛ) и мелкоклеточный рак легкого. НМРЛ является наиболее распространенным, на него приходится около 85% всех случаев заболевания [2]. НМРЛ включает неплоскоклеточную и плоскоклеточную формы, последняя из которых характеризуется видимыми под микроскопом плоскими клетками, выстилающими поверхность дыхательных путей [3].
«Рош» в иммунотерапии рака
Более 50 лет компания «Рош» занимается разработкой инновационных лекарственных препаратов, которые обеспечивают значительный прогресс в лечении онкологических заболеваний. Сегодня компания активно инвестирует в разработку инновационных методов лечения, которые помогают собственной иммунной системе человека бороться с онкологическим заболеванием.
О препарате атезолизумаб
Атезолизумаб представляет собой моноклональное антитело, направленное на взаимодействие с белком под названием PD-L1. Связываясь с PD-L1, экспрессируемым на опухолевых и на инфильтрирующих опухоль иммунных клетках, атезолизумаб предотвращает взаимодействие PD-L1 с PD-1 и B7.1. Блокируя PD-L1, атезолизумаб нормализует активацию Т-клеток. Кроме того, атезолизумаб не нарушает механизм защиты нормальных тканей от аутоиммунных реакций за счет сохранения взаимодействия PD-1 и PD-L2. Большая безопасность ингибиторов PD-L1 (в т. ч. атезолизумаба) была подтверждена в мета-анализе 125 клинических исследований иммунотерапии, включающем более 20 000 пациентов. По состоянию на 21.02.2020 г. препарат одобрен в России к применению как в виде монотерапии, так и в комбинации с таргетной терапией и/или химиотерапией при различных формах немелкоклеточного и мелкоклеточного рака легкого, некоторых типах метастатического уротелиального рака и при PD-L1-положительном метастатическом тройном негативном раке молочной железы [4].
О компании «Рош» «Рош» (Базель, Швейцария) — глобальная инновационная компания в области фармацевтики и диагностики, которая использует передовую науку, чтобы улучшить жизни людей. В 2019 году инвестиции компании в исследования и разработки составили 11,7 млрд швейцарских франков. «Рош» является одним из крупнейших разработчиков и производителей биотехнологических лекарственных препаратов для лечения онкологических, аутоиммунных, инфекционных и неврологических заболеваний. Компания также является одним из лидеров в области диагностики in vitro и гистологической диагностики онкологических заболеваний, а также пионером в области самоконтроля сахарного диабета. Объединение фармацевтического и диагностического подразделений позволяет «Рош» быть одним из лидеров в области персонализированной медицины. АО «Рош-Москва» представляет в России фармацевтическое подразделение компании. Работая со всеми заинтересованными сторонами, мы стремимся улучшить доступ российских пациентов к инновационным технологиям в лечении заболеваний. 27 препаратов компании входят в перечень ЖНВЛП. «Рош» вносит долгосрочный вклад в развитие медицины, науки, общественного здравоохранения и фармацевтической промышленности в России.
Ссылки
[1] Spigel D et al. IMpower110: Interim OS Analysis of a Phase III Study of Atezolizumab (atezo) vs Platinum-Based Chemotherapy (chemo) as 1L Treatment (tx) in PD-L1-selected NSCLC [ESMO 2019 Abstract LBA78].
[2] Всемирная организация здравоохранения: GLOBOCAN 2018 – Рак легкого: Оцененная заболеваемость, смертность и распространенность рака в мире. (на англ.). http://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf. Доступ: февраль 2020 г.
[3] Американское онкологическое общество. Что такое рак легкого? (на англ.) https://www.cancer.org/cancer/non-small-cell-lung-cancer/about/what-is-non-small-cell-lung-cancer.html. Доступ: февраль 2020 г.
[4] Инструкция по медицинскому применению лекарственного препарата Тецентрик®. Государственный реестр лекарственных средств, https://grls.rosminzdrav.ru/Default.aspx. Доступ: 21.02.2020 г.







































Twitter
Odnoklassniki
VKontakte
Telegram
RSS