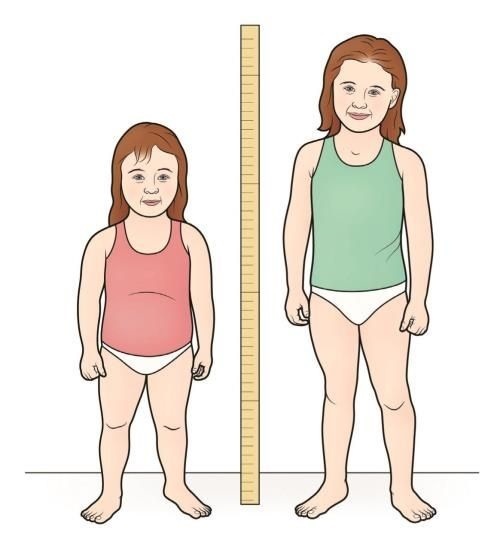
Дефицит гормона роста является самым распространенным вариантом дефицита гормонов гипофиза у детей, и может встречатся изолированно, либо в сочетании с дефицитом других гормонов гипофиза. В типичных случаях, дефицит гормона роста у детей характеризуется аномально низкой скоростью роста и низкорослостью при сохранении нормальных пропорций тела. Диагностика включает измерение уровней гормонов гипофиза, а также КТ или МРТ для обнаружения структурных аномалий гипофиза или опухолей головного мозга. Лечение обычно включает заместительную гормонотерапию и удаление опухоли, если она является причиной нарушений.
Для пациентов с дефицитом ГР, ассоциированным с генерализированным гипопитуитаризмом (пангипопитуитаризмом), также характерен дефицит одного или нескольких других гормонов гипофиза (например, фолликулостимулирующего [ФСГ], лютеинизирующего [ЛГ], адренокортикотропного [АКТГ], тиреотропного [ТГ], антидиуретического [АДГ] гормонов). Гипопитуитаризм может быть первичным (патология гипофиза) или вторичным, на фоне нарушения секреции гипоталамусом специфических рилизинг-гормонов, которые контролируют выработку гормонов передней долей гипофиза (ГР, ФСГ, ЛГ, АКТГ, ТТГ).
Этиология дефицита гормона роста у детей
Дефицит гормона роста (ГР) может возникнуть как изолировано, так и быть ассоциированным с пангипопитуитаризмом. И в том, и в другом случае, дефицит ГР может быть приобретенным или врожденным (в том числе, из-за наследственных генетических причин). В редких случаях, встречается аномалия рецепторов к ГР, которая обуславливает нечувствительность к гормону при нормальном его уровне в крови.
Изолированный дефицит ГР встречается с частотой от 1/4000 до 1/10000. Как правило, он является идиопатическим, но около 25% случаев имеют установленную этиологию. Врожденные причины включают аномалии рецептора ГР-рилизинг-гормона и GH1 генов, а также некоторые пороки развития центральной нервной системы (ЦНС). Приобретенные причины включают терапевтическое облучение ЦНС (высокие дозы радиации могут вызвать пангипопитуитаризм), менингит, гистиоцитоз и черепно-мозговую травму. Профилактическое или терапевтическое облучение позвоночника еще больше снижает ростовой потенциал позвонков и грозит дальнейшим уменьшением окончательного роста.
Пангипопитуитаризм может иметь генетические причины, такие как наследственные или спорадические мутации, которые поражают клетоки гипофиза. В таких случаях встречаются также патологии других органов и систем, в частности срединные дефекты лица такие как расщепление нёба или септооптическая дисплазия (которая включает атрезию прозрачной перегородки, атрофию зрительных нервов и гипопитуитаризм). Пангипопитуитаризм также может возникнуть вследствие разнообразных повреждений, которые влияют на гипоталамус (нарушая секрецию релизинг-гормонов) или гипофиз, примеры включают опухоли (например, наиболее часто, краниофарингиома), инфекции (например, туберкулез, токсоплазмоз, менингит) и инфильтративные процессы. Сочетание литического поражения костей скелета или черепа с несахарным диабетом указывает на лангергансоклеточный гистиоцитоз.
Симптомы и признаки дефицита гормона роста
Проявления дефицита гормона роста зависят от возраста пациента, первопричинной этиологии и дефицита специфических гормонов.
Дефицит гормона роста, как правило, проявляется в виде нарушения роста, иногда вместе с задержкой развития зубов. Рост не достигает 3-го процентиля; скорость роста до 4-летнего возраста – < 6 см/год, с 4 до 8 лет – < 5 см/год, а в пубертатном периоде – < 4 см/год. Несмотря на низкорослость, пропорции между верхним и нижним сегментами тела сохраняются нормальными. Созревание скелета (по данным определения костного возраста) замедлено, и костный возраст оказывается более чем на > 2 года хронологического.
Другие аномалии могут присутствовать, в зависимости от первопричинного дефекта, и у ребенка может возникать задержка или отсутствие полового созревания. Увеличение веса может быть непропорционально росту, что приводит к относительному ожирению. У новорожденных с врожденными дефектами гипофиза или гипоталамуса могут наблюдаться гипогликемия (которая также может возникать у детей старшего возраста), гипербилирубинемия, дефекты средней линии (например, расщелина нёба) или микропенис, а также проявления других видов эндокринной недостаточности.
Диагностика дефицита гормона роста у детей
- Клиническая оценка включает критерии роста и другие данные анамнеза жизни;
- Методы визуализации;
- Определение уровней инсулино-подобного фактора роста 1 (ИФР-1) и ИФР-связывающего белка 3 типа (ИФРСБ-3);
- Диагноз подтверждают обычно с помощью провокационных тестов;
- Проводится оценка других гормонов гипофиза и других причин плохого роста;
- Актуальные консенсусные руководства по диагностике дефицита ГР включают интегрированый анализ показателей роста, анамнеза жизни, лабораторных исследований, и результатов методов визуализации.
Показатели роста подлежат оценке. Данные о росте и весе всех детей должны заноситься в специальную карту роста для ауксологического наблюдения. (Для детей от 0 до 2 лет: см. Карты физического развития МОЗ; для детей 2 лет и старше см. Карты физического развития Центров по контролю и профилактике заболеваний).
Оценка оси ГР/ИФР-1 начинается с измерения уровней ИФР-1 (IGF-1) и ИФРСБ-3 (IGFBP-3). ИФР-1 отражает активность ГР, а ИФРСБ-3 является основным носителем пептидов ИФР. Определяются уровни ИФР-1 и ИФРСБ-3, поскольку уровень ГР является пульсирующим, сильно изменчивым и трудно интерпретируемым.
Уровни ИФР-1 варьируются в зависимости от возраста и должны быть интерпретированы в соответствии с костным, а не календарным возрастом. В младенчестве и раннем детстве (< 5 лет), уровень ИФР-1, как правило, низкий, следовательно, в этих возрастных группах сложно различить нормальный и сниженный уровень. Тем не менее, уровень ИФРСБ-3, в отличие от ИФР-1, меньше изменяется при недоедании, что позволяет различить норму и снижение значения у детей младшего возраста. В пубертатном периоде нормальный уровень ИФР-1 указывает на отсутствие дефицита ГР. Низкий уровень ИФР-1 у старших детей свидетельствует о дефиците ГР; в то же время, уровень ИФР-1 может быть низким и при состояниях, не связанных с дефицитом ГР (психосоциальная изоляция, недоедание, целиакия, гипотиреоз) и эти нарушения должны быть исключены. У детей с низкими уровнями ИФР-1 и ИФРСБ-3 дефицит ГР обычно подтверждают определением содержания самого ГР. Поскольку базальная концентрация ГР, как правило, очень низка или даже не поддается определению (за исключением первых часов после начала сна), рандомный уровень ГР не информативный и для оценки секреции ГР используют провокационные тесты. Однако такие тесты нефизиологичны, нередко случаются лабораторные ошибки, и их результаты не всегда постоянны. Кроме того, определение нормальной реакции зависит от возраста, пола и диагностического центра и имеет слабую доказательную базу.
Методы визуализации используются при нарушении роста; костный возраст следует определять рентгенографически по левой кисти (по соглашению). При дефиците ГР созревание скелета обычно замедляется в той же степени, что и рост. При дефиците ГР, для исключения кальцификаций, новообразований и структурных аномалий, показано исследование гипофиза и гипоталамуса с помощью МРТ.
Скрининговые лабораторные исследования проводят чтобы выявить другие возможные причины плохого роста, в том числе:
- Гипотиреоз (например, тиреотропный гормон, тироксин);
- Нарушения функции почек (например, электролиты, уровень креатинина);
- Воспалительные и иммунные заболевания (например, антитела к тканевой трансглутаминазе, C-реактивный белок);
- Гематологические заболевания (например, общий анализ крови с лейкоцитарной формулой).
Генетическое определение специфических синдромов (например, синдрома Тернера) проводится исходя из данных физикального исследования, или когда модель роста существенно отличается от характерной для этой семьи. При высоком уровне подозрения на дефицит ГР проводят дополнительные исследования функции гипофиза (например, АКТГ, уровень сывороточного кортизола в 8 утра, уровни лютеинизирующего, фолликулостимулирующего гормонов, а также пролактина).
Провокационные тесты
При сниженной функции щитовидной железы или надпочечников, реакция ГР обычно нарушена; поэтому у таких пациентов провокационные тесты следует проводить лишь после гормональной коррекции соответствующих состояний.
Тест на толерантность к инсулину является лучшим провокационным тестом для стимуляции выделения ГР, но он проводится редко из-за высокого риска. Другие провокационные тесты менее опасны, но также менее достоверны. Они включают тесты с использованием инфузии аргинина (500 мг/кг внутривенно вводится в течение 30 мин), клонидина (0,15 мг/м2 перорально [максимум 0,25 мг]), леводопы (10 мг/кг перорально для детей; 500 мг перорально для взрослых), и глюкагона (0,03 мг/кг внутривенно [максимум 1 мг]). Уровни ГР измеряют через разные промежутки времени после введения препаратов, в зависимости от препарата.
Поскольку ни один из таких тестов не дает 100%-ной эффективности в отношении усиления секреции ГР, проводится два провокационных теста (обычно в тот же день). После введения инсулина или начала инфузии аргинина, уровень ГР обычно достигает пика через 30–90 минут, после теста с леводопой – через 30–120 минут, после теста с клонидином – через 60–90 минут и после теста с глюкагоном – через 120-180 минут. Ответ ГР, который считается нормальным, трактуют несколько произвольно. Как правило, уровень ГР > 10 нг/мл (>10 мкг/л) после любой стимуляции является достаточным для исключения дефицита ГР. Дефицит ГР можно предполагать при ответе <10 нг/мл (< 10 мкг/л; некоторые центры используют более низкую границу, например, 7 нг/мл [7 мкг/л]) на два фармакологических раздражителя, но результаты должны быть интерпретированы в контексте ауксологических данных. Поскольку уровень ГР повышается в период полового созревания, многие дети, которые не дали ответа на провокационный тест до полового созревания, могут иметь нормальные результаты после полового созревания или при получении половых стероидов.
С помощью провокационных тестов не всегда можно выявить легкие нарушения регуляции секреции ГР. Например, у ребенка с низкорослостью, обусловленной нарушением секреции ГР, результаты провокационных тестов обычно нормальны. Однако при серийных определениях уровня ГР на протяжении 12–24 часов обнаруживается снижение 12- и 24-часовых интегральных показателей секреции ГР. Однако, этот тест дорогой и неудобный, поэтому он не является исследованием выбора при дефиците гормона роста.
Если подтверждается снижение продукции ГР, проводятся тесты секреции других гормонов гипофиза и (если есть отклонения) гормонов их периферических эндокринных желез-мишеней, наряду с визуализацией гипофиза, если это не проводилось ранее.
Лечение дефицита гормона роста у детей
- Введение рекомбинантного ГР;
- Иногда заместительная терапия другими гормонами гипофиза.
Применение рекомбинантного ГР показано всем отстающим в росте детям с доказанным дефицитом ГР. Обычно ГР вводят подкожно 1 раз/день в дозировке от 0,03 до 0,05 мг/кг. Такая терапия в первый год часто увеличивает скорость роста до 10-12 см/год в первый год и, хотя в дальнейшем скорость роста увеличивается медленнее, она все же остается выше исходной. Терапию продолжают до достижения пациентом приемлемого роста или до тех пор, пока скорость роста не упадет ниже 2,5 см/год.
Побочные эффекты терапии гормоном роста немногочисленны, но включают идиопатическую внутричерепную гипертензию (псевдоопухоль головного мозга), соскальзывание головок эпифизов бедренных костей и легкие транзиторные периферические отеки. До появления рекомбинантного ГР использовали экстракт ГР из гипофизов. Этот препарат в редких случаях вызывал болезнь Крейтцфельдта–Якоба, проявляющуюся через 20–40 лет после лечения. От применения ГР, экстрагированного из гипофиза, отказались в 1980-х годах.
Вопрос об использовании ГР в лечении низкорослых детей с клинической картиной дефицита ГР, но нормальной его секрецией и нормальным уровнем ИФР-1, остается открытым. Многие специалисты рекомендуют пробную терапию ГР в течение 6-12 месяцев, с продолжением ее только в том случае, если наблюдается удвоение скорости роста или она хотя бы на 3 см/год превышает исходную. Другие отрицают такой подход, поскольку он достаточно дорог, остается экспериментальным, может сопровождаться побочными эффектами, позволяет относиться к здоровым во всех других отношениях детям как к больным и способствует распространению «хейтизма» (дискриминации по росту).
Когда дефицит ГР сопровождается дефицитом других гормонов гипофиза, необходима дополнительная заместительная гормонотерапия. Необходимо проводить заместительную терапию кортизолом и тиреоидными гормонами в детском, подростковом возрасте, а также у взрослых, если уровни этих гормонов в сыворотке снижены. Несахарный диабет, как правило, требует пожизненного лечения десмопрессином в таблетках или интраназальной форме. В отсутствие нормального полового созревания назначают терапию половыми стероидами.
Применение ГР у детей с низкорослостью, обусловленной облучением гипофиза по поводу злокачественной опухоли, теоретически может быть сопряжено с риском рецидива опухоли. Однако, специальные исследования не выявили в таких случаях превышения ожидаемой частоты новых опухолей или рецидивов. Заместительную терапию ГР, вероятно, неопасно начинать спустя, по меньшей мере, 1 год после успешного завершения противоракового лечения.
Основные положения
- Дефицит гормона роста (ГР) может возникнуть изолрованно или в ассоциации с пангипопитуитаризмом.
- К причинам относят врожденные (в том числе, генетические) расстройств и ряд приобретенных нарушений гипоталамуса и/или гипофиза.
- Дефицит ГР вызывает низкорослость; возможны многочисленные другие проявления в зависимости от причины.
- Диагноз выставляют, основываясь на клинических проявлениях, результатах методов визуализации и лабораторных исследований, как правило, с учетом результатов провокационных тестов продукции ГР.
- Дети с низким ростом и подтвержденным дефицита ГР должны получать рекомбинантный ГР, другие проявления гипопитуитаризма корректируются по мере необходимости.
Имеются противопоказания, не занимайтесь самолечением — обратитесь к специалисту!












































Odnoklassniki
VKontakte
Telegram
RSS