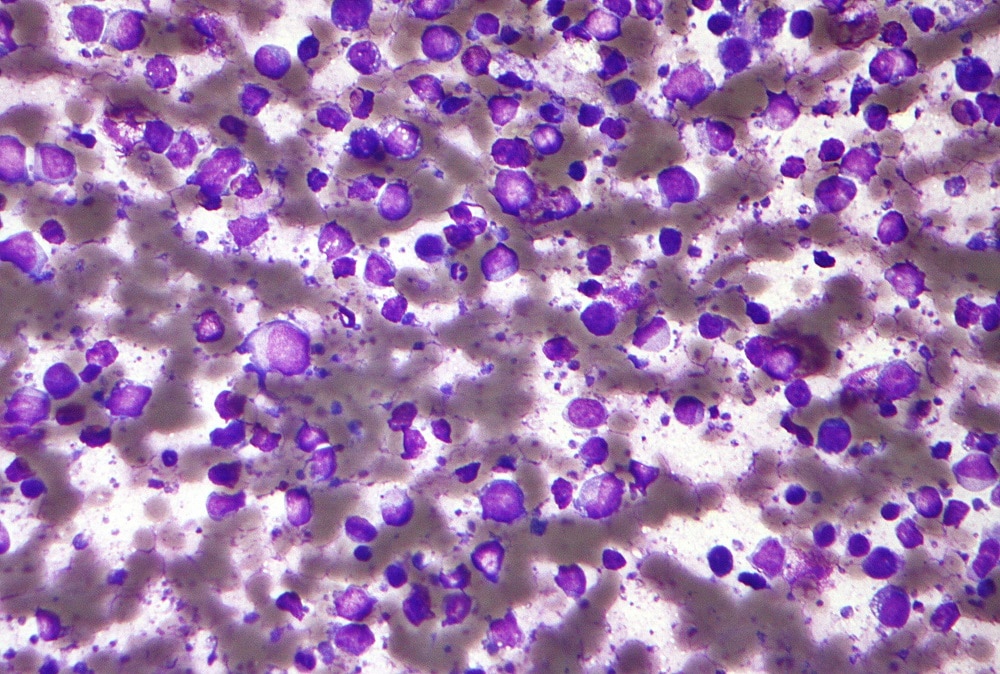
- Полатузумаб ведотин — первый в своем классе [1] конъюгат антитело-препарат, нацеленный на белок CD79b, экспрессируемый большинством B-клеток.
- Препарат продемонстрировал улучшение клинических результатов у пациентов с рецидивирующей или рефрактерной диффузной B-крупноклеточной неходжкинской лимфомой по сравнению с широко используемой терапией.
- В США препарат был зарегистрирован в июне 2019 года по ускоренному протоколу.
Москва, 6 августа 2019 г. — «Рош» сообщает о подаче в Министерство здравоохранения РФ заявки на регистрацию полатузумаба ведотина (Polivy™, рус. «Полайви»). Препарат заявлен для применения у пациентов с диффузной В-крупноклеточной неходжкинской лимфомой (ДBККЛ) в комбинации с бендамустином и ритуксимабом у пациентов, получивших, как минимум, одну линию предшествующей терапии.
Конъюгаты антитело-препарат представляют собой новый класс таргетной иммунотерапии рака. Они сочетают в себе моноклональное антитело и цитотоксический агент. В отличие от традиционной химиотерапии, действующей не избирательно и поражающей, в том числе, здоровые клетки, что обусловливает их высокую токсичность, конъюгаты антитело-препарат нацелены на опухолевые клетки, идентифицируемые конкретной молекулярной мишенью —специфическими белками на их поверхности. Моноклональное антитело связывается с этими белками и запускает процесс внедрения в клетки токсина. Благодаря этому достигается максимальная гибель опухолевых клеток, в то время как воздействие на нормальные клетки сводится к минимуму [2; 3].
Полатузумаб ведотин — это первый в своем классе конъюгат анти-CD79b антитела и лекарственного препарата (ADC). Белок CD79b является высокоспецифичным и экспрессируется при большинстве типов B-клеточных неходжскинских лимфом (НХЛ), поэтому он является перспективной мишенью при разработке новых препаратов [4; 5]. Полатузумаб ведотин связывается с CD79b, инициируя интернализацию терапевтического средства (монометилауристатин Е (ММАЕ)) в В-клетку.
Оценка эффективности и безопасности препарата проводилась в рамках клинического исследования фазы Ib/II GO29365. В нем применение полатузумаба ведотина в комбинации с бендамустином и ритуксимабом (BR) показало более высокий уровень ответа по сравнению с BR (широко используемый режим) у пациентов с рецидивирующей или рефрактерной диффузной B-крупноклеточной неходжкинской лимфомой (р/р ДВККЛ), которым не показана трансплантация гемопоэтических стволовых клеток.
Полатузумаб ведотин разрабатывается компанией «Рош» с помощью технологии ADC (Antibody-Drug Conjugate — англ. «конъюгат антитело-препарат») компании Seattle Genetics и в настоящее время исследуется для лечения нескольких типов неходжскинской лимфомы.
Ранее Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило полатузумаб ведотин по ускоренной процедуре [6]. Препарат также получил статус «прорыв в терапии» от FDA [7] и включен в программу по приоритетным препаратам PRIME (PRIority MEdicines) Европейского агентства по лекарственным средствам (EMA) для лечения пациентов с р/р ДВККЛ.
Диффузная B-крупноклеточная неходжкинская лимфома (ДВККЛ) — наиболее распространенный подтип неходжскинской лимфомы (НХЛ), встречающийся примерно в каждом третьем случае НХЛ [8]. ДВККЛ — это агрессивный, то есть быстро развивающийся, подтип НХЛ, при котором ответ на терапию обычно достигается в первой линии [9]. Однако примерно у 40% пациентов возникает рецидив, после чего варианты терапии спасения ограничены, а продолжительность жизни значительно сокращается [3; 4]. В возрасте до 18 лет частота ДВККЛ не превышает 8-10%. Ежегодно в мире диагностируется около 150 тысяч случаев заболевания ДВККЛ [10]. По данным клинических рекомендаций Минздрава РФ, заболеваемость ДВККЛ составляет в среднем 4–5 на 100 000 населения в год [11].
На текущий момент стандартом первой линии терапии ДВККЛ является иммунохимиотерапия ритуксимабом и CHOP (R-CHOP) R-CHOP-21. Для больных с рецидивами или рефрактерным течением ДBККЛ в зависимости от возраста и коморбидности могут применяться различные режимы химиотерапии, высокодозная химиотерапия и аутологичная трансплантация гемопоэтических стволовых клеток (аутоТГСК) [12].
Об исследовании GO29365
GO29365 — международное исследование фазы Ib/II по оценке безопасности, переносимости и активности полатузумаба ведотина в комбинации с бендамустином и ритуксимабом или обинутузумабом при рецидивирующей или рефрактерной (р/р) фолликулярной лимфоме или диффузной В-крупноклеточной неходжкинской лимфоме (ДВККЛ). Пациенты, подходящие для включения в исследование, не являлись кандидатами для трансплантации гемопоэтических стволовых клеток на момент включения. В исследовании фазы II 80 пациентов с р/р ДВККЛ, ранее уже получивших интенсивное лечение, были рандомизированы для получения комбинации бендамустин плюс ритуксимаб (BR), или BR в комбинации с полатузумабом ведотином в течение фиксированного интервала времени — шести циклов длительностью 21 день каждый. До участия в исследовании пациенты получили в среднем две линии терапии (от 1 до 7 в группе с полатузумабом ведотином, от 1 до 5 в группе BR). Первичной конечной точкой был полный ответ (ПО) на момент завершения лечения по результатам позитронно-эмиссионной томографии (ПЭТ) по оценке независимого наблюдательного комитета (ННК). Остальные ключевые конечные точки включали частоту объективного ответа (ЧОО: полный и частичный ответ) по оценке исследователей и наилучший объективный ответ по окончанию лечения по оценке исследователей и ННК. Конечные точки включали в себя длительность ответа, выживаемость без прогрессирования заболевания (ВБП), бессобытийную выживаемость и общую выживаемость.
Результаты исследования показали, что 40% участников, получавших полатузумаб ведотин плюс BR достигли полного ответа (n=16/40; 95% CI: 25-57), так что на момент оценки заболевание у них не обнаруживалось, по сравнению с 18% пациентов в группе, где применялась только комбинация BR (n=7/40; 95% CI: 7-33). Показатели частоты полного ответа оценивались независимым наблюдательным комитетом. Исследование также показало, что 45% пациентов, получавших полатузумаб ведотин плюс BR, достигли объективного ответа на конец лечения (n=18/40; 95% CI: 29-62), по сравнению с 18% пациентов, получавших только BR (n=7/40; 95% CI: 733). Из тех, кто получал полатузумаб ведотин плюс BR и достиг полного или частичного ответа, у 64% (n=16/25) длительность ответа (ДО) составила не менее шести месяцев по сравнению с 30% (n=3/10) пациентов, получавших только BR. Кроме того, у 48% (n=12/25) пациентов в группе полатузумаб ведотин плюс BR показатель длительности ответа составил не менее года, по сравнению с 20% (n=2/10) пациентов с таким же результатом из тех, кто получал только BR. Нежелательные реакции, наблюдавшиеся не менее чем у 20% пациентов и при этом, как минимум, на 5% чаще у пациентов в группе полатузумаба ведотина плюс BR по сравнению с BR, включали низкий уровень лейкоцитов, тромбоцитов и эритроцитов, онемение, покалывание или боль в руках и ногах, диарею, лихорадку, снижение аппетита и пневмонию.
«Рош» в гематологии
Более 20 лет компания «Рош» занимается разработкой инновационных лекарственных препаратов, которые обеспечивают значительный прогресс в лечении злокачественных и незлокачественных гематологических заболеваний. Компания обладает обширными знаниями и опытом в этой терапевтической области. В настоящее время «Рош» прикладывает большие усилия и инвестирует в разработку инновационных способов лечения пациентов, страдающих гематологическими заболеваниями. В нашем портфеле препаратов представлены ритуксимаб (Мабтера®), обинутузумаб (Газива®), полатузумаб ведотин (Polivy™) [13], венетоклакс [14] (в сотрудничестве с AbbVie) и эмицизумаб (Гемлибра®). Портфель исследуемых лекарственных препаратов для лечения онкогематологических заболеваний включает идасанутлин – малую молекулу – антагонист взаимодействия MDM2 с p53, биспецифические антитела с участием Т-клеток, нацеленные на CD20 и CD3, а также атезолизумаб (Тецентрик®), моноклональное антитело, предназначенное для связывания с PD-L1. Наш научный опыт, в сочетании с широким портфелем и линейкой перспективных препаратов, предоставляют уникальную возможность для разработки комбинированных режимов терапии, направленных на дальнейшее улучшение жизни пациентов.
Все товарные знаки, используемые или упомянутые в этом сообщении, защищены законом.
Ссылки
[1] Medscape. FDA Approves First Chemoimmunotherapy for R/R Lymphoma Type. https://www.medscape.com/viewarticle/914185. Доступ: 29.07.2019 г.
[2] Ducry L, Stump B. Antibody-drug conjugates: linking cytotoxic payloads to monoclonal antibodies. Bioconjug Chem. 2010; 21:5 — 13. [3] ADC Review. What are antibody-drug conjugates? https://adcreview.com/adc-university/adcs-101/antibody-drug-conjugates-adcs/. Доступ: 29.07.2019 г.
[4] Dornan D, et al. Therapeutic potential of an anti-CD79b antibody-drug conjugate, anti-CD79b-vc-MMAE, for the treatment of non-Hodgkin lymphoma. Blood 2009; 114:2721-2729.
[5] Pfeifer M, et al. Anti-CD22 and anti-CD79B antibody drug conjugates are active in different molecular diffuse large B-cell lymphoma subtypes. Leukemia 2015; 29:1578-1586.
[6] FDA approves first chemoimmunotherapy regimen for patients with relapsed or refractory diffuse large B-cell lymphoma. https://www.fda.gov/news-events/press-announcements/fda-approves-first-chemoimmunotherapy-regimen-patients-relapsed-or-refractory-diffuse-large-b-cell
[7] FDA approves polatuzumab vedotin-piiq for diffuse large B-cell lymphoma. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-polatuzumab-vedotin-piiq-diffuse-large-b-cell-lymphoma. Доступ: 29.07.2019 г.
[8] Lyon, France. World Health Organization Classification of Tumors of Haematopoietic and Lymphoid Tissues. IARC Press; 2008.
[9] Maurer, JM et al. Event-free survival at 24 months is a robust end point for disease-related outcome in diffuse large B-cell lymphoma treated with immunochemotherapy. J Clin Oncol 2014; 32:1066-73.
[10] Numbers derived from GLOBOCAN 2018: Estimated cancer incidence, mortality and prevalence worldwide in 2018. [Интернет; июнь 2019 г.]. Доступно по ссылке: http://globocan.iarc.fr.
[11] Клинические рекомендации. Диффузная В-крупноклеточная лимфома у взрослых. 2016 г.
[12] Клинические рекомендации по диагностике и лечению диффузной В-крупноклеточной лимфомы взрослых. Под ред. В.Г.Савченко и И.В.Поддубной. 2014 г.
[13] Препарат не зарегистрирован в РФ.
[14] Держателем регистрационного удостоверения в РФ является ООО «Эббви». Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru/Default.aspx. Доступ: 29.07.2019 г.







































Twitter
Odnoklassniki
VKontakte
Telegram
RSS